|
Espectros de Emisión y Absorción de los gases. El estudio
de fenómenos físicos asociados con la luz permitió aplicar durante muchos años
la excitación de gases o vapores de sustancias para generar luz. De esta forma
se podían iluminar espacios a través de: 1.
Una
descarga eléctrica generada en un espacio cerrado en el cual se encuentra
confinado un gas. 2.
Una corriente eléctrica continua
en un gas confinado a baja presión. 3.
La generación de una alta
temperatura al calentar un gas.
Figura 1.
Anuncio luminoso con Neón [2]. El físico británico Thomas Melvill en conocido como
el padre la espectroscopía de emisión de llama, esto por sus investigaciones
sobre la identificación de la luz, especialmente por la conferencia “Observaciones sobre la Luz y los Colores”,
dictada ante la Sociedad Médica de Edimburgo en 1752 [3]. De los experimentos
de Melvill, se demuestra que la luz emitida por un
gas es una combinación de unos cuantos colores con longitudes de onda muy restringidos.
Estos tipos de espectros se conocen como: Espectros de Emisión. Su estudio, así como otros fenómenos
asociados a la interacción entre la radiación electromagnética y la materia,
con absorción o emisión de energía radiante son materia de la Espectroscopía.
Figura 2. Combinación de luces de colores. La Espectroscopía moderna se sustenta
en las investigaciones de Robert W. Eberhard Bunsen y Gustav R. Kirchhoff en
1860, ambos profesores en la Universidad Alemana de Heidelberg. En cierta
ocasión observaron un incendio en el puerto de Hamburgo a unos 80 km de
distancia de donde se encontraban, se les ocurrió hacer pasar por un prisma
la luz proveniente del incendio y observaron una luz amarilla similar a la
que habían observado al quemar sodio. En poco tiempo encontraron la
explicación, en el incendio se había quemado un almacén de sal. Este
acontecimiento permitió deducir la presencia de sodio observando la luz de
las llamas. Posteriormente
descubrieron que cada átomo, sin importar su estado, al ser calentado emite
una luz de colores característicos.
Figura
3. Descomposición de luz blanca con un prisma. El espectro continuo de luz blanca contiene el conjunto de colores que
corresponde a la gama de longitudes de onda que la integran. Sin embargo, de
forma especial los elementos químicos en estado gaseoso y sometidos a
temperaturas elevadas producen espectros discontinuos en los que se aprecia
un conjunto de líneas que corresponden a emisiones de sólo algunas longitudes
de onda.
De esta forma, el conjunto de líneas espectrales que se obtiene para
un elemento de la tabla periódica es siempre el mismo, incluso si el elemento
se encuentra combinado con otros elementos en un compuesto. Por lo que se
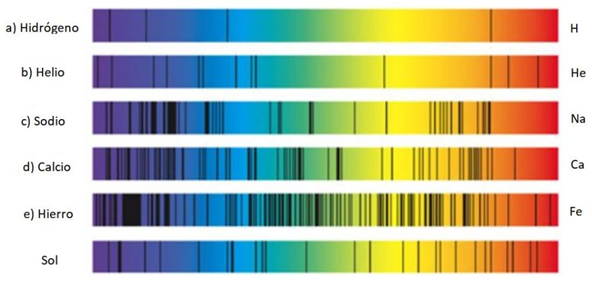
puede considerar que cada elemento tiene una única firma espectral, a lo que
también se conoce como su huella digital espectral. Esto de debe a que cada átomo
tiene su propia configuración de electrones y niveles de energía permitidos.
Figura 4 Espectros de
absorción de diferentes sustancias y el del Sol. Referencias. [1] Universidad
del País vasco, Cuaderno de Cultura Científica, Los espectros de emisión de
los gases, 06/08/2019, sitio en internet: https://culturacientifica.com/2019/08/06/los-espectros-de-emision-de-los-gases/
, consulta: 04/12/2022. [2] Jantec Neon Products,
2022, sitio en internet: https://www.jantecneon.com/FF-70-30.html
, consulta: 04/14/2022. [3] Melvill, Thomas (1756). «Observations on light and colours». Essays
and Observations, Physical
and Literary. Read Before a Society in Edinburgh,
… 2: 12-90., pp. 33–36. |